Gebärmutterhalskrebs Früherkennung nach europäischen Leitlinien1
Gebärmutterhalskrebs –Sterblichkeit in Europa
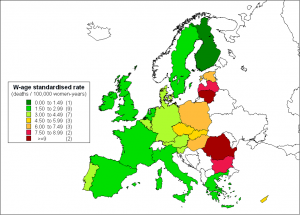
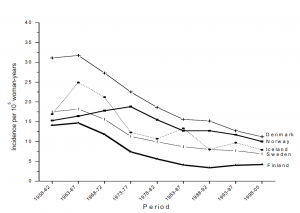
Abb 1. Sterblichkeit an Gebärmutterhalskrebs in den 27 Mitgliedsstaaten der Europäischen Union, (altersstandardisiert nach Weltbevölkerung) im Jahr 2004. Adaptiert aus: Arbyn et al., 2007a & b. (Anklicken für größere Ansicht)
Von allen malignen Tumorerkrankungen kann die Ausbreitung und die Sterblichkeit an Gebärmutterhalskrebs, auch Cervixkarzinom genannt, am wirkungsvollsten durch Screeningprogramme verringert werden. Denn diese Krebserkrankung ist gekennzeichnet durch eine lang anhaltend präkanzeröse Phase, in der Auffälligkeiten gut erkannt werden können. Die Screeninguntersuchung besteht im Nachweis zytologischer Auffälligkeiten beim sogenannten Pap Abstrich. Die Behandlung der im Screening entdeckten high-grade Veränderungen verhindert das Auftraten einer Gebärmutterhalskrebs-Erkrankung. Dabei ist die Durchführung von gut organisierten, bevölkerungsbezogenen zytologischen Screeningprogrammen im Abstand von 3-5 Jahren in der Lage, die Neuerkrankungsrate um 80% zu reduzieren (IARC, 2005). Solche organisierten zytologischen Screeningprogramme jedoch sind nur in Norwegen, Schweden, Finnland, Dänemark, dem Vereinigten Königreich, den Niederlanden und Teilen von Italien etabliert. In den anderen Ländern, so auch in Deutschland, existiert ein sogenanntes graues oder opportunistisches Screening, das nicht bevölkerungsbezogen und nicht qualitätsgesichert durchgeführt wird. Dies hat viele Nachteile gegenüber dem kontrollierten Screeningprogramm: in Abhängigkeit von sozio-ökonomischen Bedingungen werden Frauen einerseits zu oft und in falschen Altersgruppen untersucht oder eben gar nicht vom Screening erfasst. Die mangelnde Qualitätskontrolle führt zu sehr heterogenen Ergebnissen (falsch positive, falsch negative Befunde, schlechte Vorhersagewerte, geringe Effizienz des Screenings).
Wie muss ein effektives Screeningprogramm aussehen?
Nur ein organisiertes Programm ist in der Lage, die Vorteile zu maximieren und die möglichen Nachteile so gering wie möglich zu halten. Dazu gehört die epidemiologische Begleitung und Erfassung der Krankheitsdaten vor und während des Screenings, die bevölkerungsbezogene Einladung der Zielgruppe und die sorgfältige Qualitätskontrolle in allen Screening-Bereichen. Für diejenigen Frauen, bei denen im Screening auffällige Befunde entdeckt werden, müssen Follow-Up und Behandlungsoptionen bereitgestellt werden und die Effektivität des Scrrenings, also die senkung von Inzidenz und Sterblichkeit nachgewiesen werden
Im Jahr 2004 wurden 52.000 neue Gebärmutterhalskrebs-erkrankungen in Europa diagnostiziert und 27.000 Frauen starben daran. Besonders hohe Raten wurden in Ost-und Zentraleuropa registriert, mit einer 5fach höheren Erkrankungs-und Sterbehäufigkeit im Vergleich zu den Ländern mit den niedrigsten Raten. (Abb.2)
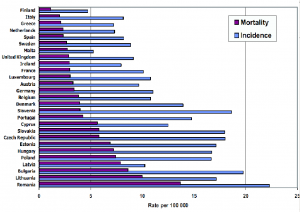
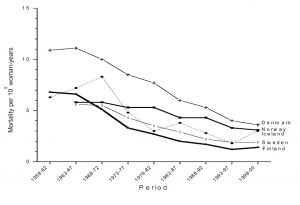
Abb.2 Altersstandardisierte Inzidenz und Sterblichkeit an Zervixkarzinom 2004 (/100,000 Frauenjahre) in den 27 Mitgliedsstaaten der Europäischen Union, (direkte Standardisierung nach Weltpopulation). (adaptiert aus: Arbyn et al., Ann Oncol. 2007b). (Anklicken für größere Ansicht)
Die Erkrankungshäufiket (Inzidenz) und Sterblichkeit (Mortalität) an Gebärmutterhalskrebs sinkt mit der Einführung von Gebärmutterhalskrebs-Screening. Abbildung 3 zeigt, dass der Effekt des Screenings besonders stark ist, wenn es als bevölkerungsbezogenes, kontrolliertes Screeningprogramm wie in Finnland seit den 60er Jahren des vorigen Jahrhunderts. In Norwegen, wo die Sterblichkeit kaum im Beobachtungszeitraum gesunken ist, wurde ers 1995 ein organisiertes Screeningprogramm gestartet. Vorher existierte dort, wie in Deutschland bis heute, nur ein sogenanntes „opportunistisches“ Screening. Daten aus Großbritannien zeigen, dass im organisierten Programm, die Sterblichkeit um 7% pro Jahr gesenkt wird, im opportunistisches Screening jedoch lediglich ein Rückgang von 1-2% pro Jahr (Peto J et al. The cervical cancer epidemic that cervical cancer screening has prevented in the UK. Lancet 2004).
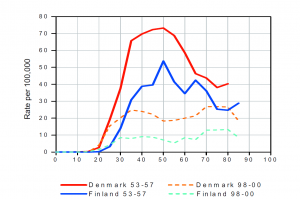
Die Altersverteilung bei Diagnose und die Erkrankungshäufigkeit ist von Land zu Land verschieden. So ist die Inzidenz in Finnland in allen Altersgruppen deutlich niedriger als in Dänemark vor Einführung des Screenings (Zeitraum 1953-57) und nach Einführung des Screenings (1998-2000).
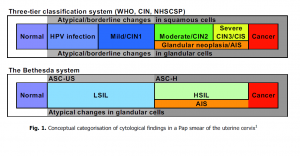
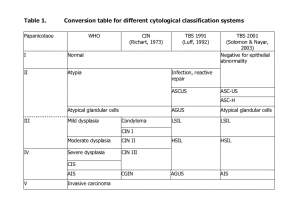
Die Klassifikation der Gebärmutterhalskrebs-Zytologie wird anhand verschiedener Klassifikationssysteme vorgenommen (Abb.4) . Das Bethesda System (TBS) ist das in der Welt gebräuchlichste, da wissenschaftlich überprüft und validiert. Die Europäischen Leitlinien empfehlen daher, dass alle Klassifikationssysteme in das TBS System „übersetzbar“ sein müssen. (Das hierzulande nioh weit verbreitete numerische Papanicolaou –System soll nicht mehr benutzt werden). Die Veränderungen der Epithel- Zellen werden nach zytologischen (LSIL, HSIL)oder histologischen (CIN) Graden eingestuft . Atypische Veränderungen werden als ASC-US: atypical squamous cells of undetermined significance, atypische Epithelzellen mit unbekannter Bedeutung) . ASC-H bezeichnet atypische Epithel-Zellen , high grade eingeschlossen. Glanduläre (Drüsen-) zellen sind seltener im Abstrich zu finden als Epithelzellen, sind aber daher besonders schwierig beim Screening zu entdecken. Atypiche glanduläre Zellen können ein Hinweis auf ein Karzinom sein und sollten deshalb beachtet werden. Die Diagnose eines Adenocarcinoma in situ der Endozervix (AIS) und das Adenocarcinom kann nur mit der histologischen Biopsie (Gewebeentnahme) gestellt werden.
Die Klassifikationen TBS (The Bethesda System) und das dreigliedrige WHO System der Abstrichs-Zytologie-Ergebnisse (Abb.4)
Tabelle 1 zeigt die Übertragung des in Deutschland noch gebräuchlichen numerischen Papanicolaou-Systems in die international empfohlene TBS- und die WHO Klassifikationen: Normale Abstrich-zytologie (Pap I) , Atypien (ASCUS, ASC-US, ASC-H atypische glanduläreZellen, Pap II), Milde und Moderate Dysplasien (Condyloma, LSIL, CIN I, Moderate Dysplasien: HSIL, CIN II), Pap III, Schwere Dysplasien: (CIN III, CIS (carcinoma in situ) , AIS) Pap IV, Invaisves Karzinom, Pap V.
- European guidelines for quality assurance in cervicalcancer screening (2nd edition) © European Communities, 2008 ↩